Selamat Datang di website Belajar Asam Basa
Website ini berisi materi Asam Basa SMA kelas XI yang meliputi pengertian asam basa, teori asam basa, perhitungan pH, serta dilengkapi juga dengan evalusi untuk mengecek pemahaman siswa.
Pembuatan website dimaksudkan untuk memenuhi tugas akhir dari mata kuliah Pengembangan Media Pembelajaran.
Biodata Pembuat Website :
Nama : Rizky Dwi Fitriani
Kelas : Pendidikan Kimia B 2009
NIM : 093194212
Jurusan : Kimia - Universitas Negeri Surabaya
e-mail : rizkydwifitriani@ymail.com
Semoga website ini bermanfaat bagi siswa SMA untuk memperoleh literatur atau sumber materi asam basa. Selain itu pembuatan website ini juga diharapkan dapat memberikan solusi mengenai keterbatasan waktu tatap muka di sekolah antara guru dengan siswa. Dengan adanya website ini siswa tetap dapat memperoleh materi. Disisi lain website ini juga diharapkan dapat meingkatkan keterampilan psikomotor siswa dalam memanfaatkan teknologi informasi yang semakin berkembang ini.
Tentunya pembuatan website ini masih jauh dari kesempurnaan. Oleh karena itu masukan positif yang dapat meningkatkan kualitas website ini sangat diharapkan. Anda dapat mengirimkannya melalui e-mail yang tertera diatas.
Salam
Rizky Dwi Fitriani
Blog ini berisi tentang materi-materi asam basa yang meliputi pengertian, teori, identifikasi, contoh dalam kehidupan sehari-hari, dan soal evaluasi.
Kategori
- * Home *
- * Kompetensi *
- Asam Basa Dalam Kehidupan Sehari-Hari
- Asam Basa Konjugasi
- Hubungan α - Ka - dan Kb
- Identifikasi Asam dan Basa
- Konsep pH
- Menghitung pH Asam
- Menghitung pH Basa
- Pengertian Asam dan Basa
- Teori Asam Basa Arhenius
- Teori Asam Basa Bronsted-Lowry
- Teori Asam Basa Lewis
- Tetapan Kesetimbangan Air (Kw)
- X-tra : Evaluasi
Rabu, 13 Juni 2012
Selasa, 12 Juni 2012
Kompetensi Pembelajaran
Standar
Kompetensi : Memahami sifat-sifat larutan asam-basa, metode
pengukuran, dan terapannya.
Kompetensi
Dasar :
Mendeskripsikan teori-teori asam basa dengan menentukan sifat larutan dan
menghitung pH larutan.
Indikator
Pembelajaran :
- Menjelaskan pengertian dan sifat-sifat dari larutan asam dan basa.
- Menjelaskan teori asam dan basa menurut Arrhenius.
- Menjelaskan teori asam dan basa menurut Bronsted dan Lowry.
- Menuliskan persamaan reaksi asam dan basa menurut Bronsted dan Lowry dan menunjukkan pasangan asam dan basa konjugasinya.
- Menjelaskan pengertian asam dan basa menurut Lewis.
- Mengidentifikasi sifat larutan asam dan basa dengan berbagai indikator.
- Menghitung dan menentukan tetapan kesetimbangan air (Kw)
- Menjelaskan pengertian kekuatan asam dan menyimpulkan hasil pengukuran pH dari beberapa larutan asam dan basa yang konsentrasinya sama.
- Menghubungkan kekuatan asam atau basa dengan derajat pengionan ( α ) dan tetapan asam (Ka) atau tetapan basa (Kb).
- Menghitung pH larutan asam atau basa yang diketahi konsentrasinya.
Pengertian Asam dan Basa
Asam didefinisikan sebagai senyawa yang menghasilkan ion hidrogen (H+) ketika
larut dalam pelarut (biasanya air).
Basa didefinisikan sebagai senyawa yang menghasilkan
ion hidroksida (OH-) ketika larut dalam pelarut air.
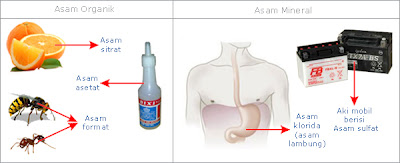
Asam Basa Dalam Kehidupan Sehari-Hari
Contoh-contoh Asam
Asam dapat dengan mudah
kita temui dalam kehidupan sehari-hari. Dalam makanan, minuman, buah-buahan,
air hujan bahkan di dalam tubuh kita. Berdasarkan asalnya, asam dikelompokkan
menjadi 2 kelompok, yaitu asam organik dan asam mineral.
Asam organik berasal
dari sumber alami (tumbuhan dan hewan), umumnya bersifat asam lemah. Contoh
asam organik adalah asam sitrat terdapat dalam buah jeruk, asam format terdapat
dalam gigitan/sengatan semut dan sengatan lebah dan asam asetat yang terdapat
dalam cuka makan. Asam mineral adalah senyawa asam seperti asam klorida (asam
lambung) terdapat dalam sistem pencernaan manusia dan hewan. Asam mineral
banyak juga dimanfaatkan oleh manusia untuk memenuhi kebutuhan sehari-hari dan
umumnya bersifat asam kuat. Contoh asam mineral adalah asam klorida yang
digunakan secara luas dalam industri, asam sulfat untuk aki mobil dan asam
fluorida yang biasanya digunakan pada pabrik kaca.
Berdasarkan kekuatannya
asam dibagi menjadi dua jenis, yaitu asam kuat dan asam lemah. Kekuatan suatu
asam dapat ditentukan dari kemampuannya melepaskan ion hidrogen yang bermuatan
positif (ion H+) ketika dilarutkan dalam air. Semakin banyak ion H+ yang
dilepaskan, semakin kuat sifat asamnya.
Berikut ini adalah tabel
beberapa contoh asam kuat dan asam lemah.
Contoh-contoh Basa
Sama halnya dengan zat
asam, zat basa juga dapat dengan mudah kita temui dalam kehidupan sehari-hari.
Sifat licin dan rasanya yang pahit merupakan cara mudah untuk mengenali zat
basa. Beberapa contoh zat basa yang sering digunakan adalah:
- Natrium hidroksida / soda api /
soda ash dan kalium hidroksida, sebagai bahan baku pembersih dalam rumah
tangga, misalnya sabun mandi, sabun cuci, detergen, pemutih dan pembersih
lantai
- Magnesium hidroksida dan
aluminium hidroksida, terkandung dalam obat nyeri lambung (antasid)
- Amoniak, untuk pelarut
desinfektan (pencegah terjadinya infeksi) dan bahan baku pupuk urea
Sama seperti asam, basa
juga dibedakan menjadi basa kuat dan basa lemah. Kekuatan suatu basa dapat
ditentukan dari kemampuannya melepaskan ion hidroksida yang bermuatan negatif
(ion OH-) ketika dilarutkan dalam air. Semakin banyak ion OH- yang
dilepaskan, semakin kuat sifat basanya. Semua rumus kimia basa umumnya
mengandung gugus OH-.
Jika diketahui rumus
kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama
logam dan diikuti kata hidroksida. Berikut ini tabel beberapa contoh basa kuat
dan basa lemah:
Teori Asam Basa Arhenius
Arhenius
mendefinisikan :
Jumlah
ion H+ yang dapat dihasilkan oleh 1 molekul asam
disebut valensi asam, sedangkan ion negatif yang terbentuk dari asam
setelah melepaskan ion H+ disebut ion sisa asam. Beberapa
contoh asam diberikan pada tabel :
Jumlah
ion OH- yang dapat dilepaskan oleh satu
molekul basa disebut valensi basa. Beberapa contoh basa diberikan pada tabel
:
Teori Asam Basa Bronsted-Lowry
Menurut Bronsted-Lowry :
Perhatikan reaksi
berikut :
Dari reaksi di atas terlihat bahwa CH3COOH memberi 1 proton (H +) kepada H2O, sehingga CH3COOH
bersifat sebagai asam dan H2O bersifat sebagai basa.
Asam Basa Konjugasi
Bronsted-Lowry
juga menyatakan bahwa jika suatu asam memberikan proton (H+), maka
sisa asam tersebut mempunyai kemampuan untuk bertindak sebagai basa. Sisa asam
tersebut dinyatakan sebagai basa konjugasi. Demikian pula untuk basa, jika
suatu basa dapat menerima proton (H+), maka zat yang terbentuk
mempunyai kemampuan sebagai asam disebut asam konjugasi.
Pada
reaksi tersebut terlihat bahwa H2O dapat bersifat sebagai asam dan
basa. Zat yang demikian disebut zat amfoter. Zat amfoter artinya zat yang
memiliki kemampuan untuk bertindak sebagai asam atau basa. Contoh lain yang
termasuk amfoter adalah HCO3–.
Contoh
basa konjugasi:
Asam →
Proton + Basa Konjugasi
HCl(aq)
⇄H+(aq)
+ Cl–(aq)
H2O(aq)
⇄H+(aq)
+ OH–(aq)
H2SO4(aq)
⇄H+(aq)
+ SO42–(aq)
NH4 +(aq) ⇄H+(aq) + NH
Contoh
asam konjugasi sebagai berikut.
Basa
+Proton → Asam Konjugasi
NH3(aq)
+ H+(aq) ⇄ NH4+(aq)
H2O(aq)
+ H+(aq) ⇄ H3O+(aq)
OH–(aq)
+ H+(aq)⇄ H2O(aq)
CO32–(aq)
+ H+(aq) HCO3–(aq)
Perhatikan
reaksi berikut:
HCl(aq)
+ H2O(l) ⇄ H3O+(aq)
+ Cl‑(aq)
Pasangan
asam-basa setelah terjadi serah terima proton dinamakan asam basa konjugasi.
a. HCl
dan Cl– merupakan
pasangan asam-basa konjugasi. HCl adalah asam konjugasi dari Cl–dan
Cl– adalah basa
konjugasi dari HCl.
b. H2O
dan H3O+ merupakan
pasangan asam-basa konjugasi. H2O adalah basa konjugasi dari H3O+ dan H3O+ adalah asam konjugasi dari H2O.
Berikut
ini contoh pasangan asam-basa konjugasi pada beberapa reaksi.
a. HNO3(aq)+
H2O(l) ⇄H3O+(aq)+
NO3–(aq)
b. H2O(l)
+ CN–(aq) ⇄
HCN(aq)+ OH–(aq)
c. H2SO4(aq)+
OH–(aq) ⇄ HSO4–(aq)
+ H2O(aq)
Teori Asam Basa Lewis
Lewis
mendefinisikan :
Contoh :
Dalam kulit valensi atom N dalam
molekul NH3, terdapat 3 (tiga pasang ikatan (N-H) dan 1 (satu)
pasang elektron tidak berpasangan (:), sedangkan untuk atom B dalam
molekul BF3, terdapat 3 (tiga pasang elektron yang berikatan
(B-F). Sepasang elektron tida berikatan dapat disumbangkan kepada atom pusat B
yang kemudian digunakan bersama-sama, sehingga terjadi ikatan kovalen
koordinasi (B-N).
Identifikasi Asam dan Basa
Menguji suatu zat bersifat asam atau basa,
proses yang dilakukan tidak dianjurkan dengan cara mencicipinya, karena banyak
zat asam atau basa yang dapat merusak kulit (korosif) atau bahkan bersifat
racun. Asam dan basa dapat diidentifikasi dengan menggunakan zat yang disebut
indikator.
Indikator adalah zat yang dapat memberi
warna berbeda dalam lingkungan asam dan lingkungan basa. Indikator dapat
dibedakan menjadi indikator alami dan indikator buatan. Prinsip indikator
adalah bahan yang memberikan warna berbeda pada lingkungan asam dan basa. Pada
umumnya bahan yang memiliki warna menyolok memiliki sifat memberikan warna yang
berbeda pada kedua suasana tersebut.
Berdasarkan asalnya, indikator asam basa
dapat dibedakan menjadi :
Berikut ini adalah tabel warna dalam
larutan asam dan basa beberapa indikator:
Tetapan Kesetimbangan Air (Kw)
Air merupakan pelarut
yang unik, masih ingatkah kalian pengertian asam dan basa
menurut Bronsted-Lowry? Apakah air termasuk asam atau basa? Menurut
Bronsted-Lowry, air dapat bertindak sebagai asam maupun basa (bersifat
amfoter). Air berfungsi sebagai basa dalam reaksi dengan asam-asam seperti HCl
dan CH3COOH, namun juga berfungsi sebagai asam dalam reaksi dengan
basa seperti NH3. Air merupakan elektrolit yang sangat lemah karena
hanya sebagian kecil dari air terionisasi menjadi ion H+ dan OH- :
Tetapan kesetimbangan
untuk air yaitu :
Karena fraksi molekul
air yang terionisasi sangat kecil, konsentrasi air yaitu H2O
hampir-hampir tidak berubah. Dengan demikian :
K [H2O]
= Kw = [H+] [OH-]
Konstanta kesetimbangan
air (Kw) merupakan hasil kali antara konsentrasi molar ion H+ dengan
ion OH- pada suhu tertentu. Dalam air murni pada suhu 25oC,
konsentrasi ion H+ sama dengan ion OH-. Penambahan
suatu asam akan menyebabkan [H+] dalam larutan bertambah,
tetapi tidak akan mengubah hasil kali [H+] dan [OH-].
Hal ini disebabkan karena kesetimbangan akan bergeser ke kiri yang menyebabkan
pengurangan [OH-], begitu pula sebaliknya. Sehingga :
Dalam air murni
(larutan netral) : [H+] = [OH-]
Dalam larutan
asam
: [H+] > [OH-]
Dalam larutan
basa
: [H+] < [OH-]
Berikut ini merupakan
harga tetapan kesetimbangan air pada suhu tertentu:
Konsep pH
Derajat keasaman dan kebasaaan adalah bilangan yang
menyatakan jumlah ion hidrogen (H+) dan jumlah ion hidroksil (OH-)
dalam suatu zat.
Semakin asam suatu zat, semakin banyak ion H+ dan
semakin sedikit jumlah ion OH- di dalam air. Sebaliknya semakin
basa suatu zat, semakin sedikit jumlah ion H+ dan semakin
banyak ion OH- di dalam air. Jumlah ion H+ dan
OH- di dalam air dinyatakan dengan pH atau pOH.
Derajat keasaman atau kebasaan suatu zat hanya
dinyatakan dengan skala pH. Derajat keasaman suatu zat (pH) ditunjukkan dengan
skala 0-14.
Sifat asam atau basa ditentukan oleh skala pH seperti
berikut:
- Larutan
dengan pH < 7 bersifat asam.
- Larutan
dengan pH = 7 bersifat netral.
- Larutan
dengan pH > 7 bersifat basa.
Semakin kecil nilai pH, maka zat tersebut semakin
bersifat asam. Sedangkan semakin besar nilai pH suatu zat, maka zat tersebut
semakin bersifat basa.
Dalam bentuk matematis pH dapat dinyatakan sebagai persamaan berikut :
pH =
–log [H+]= log pH = [H+]-1
pOH = –log [OH–] = log pOH = [OH-]-1
pOH = –log [OH–] = log pOH = [OH-]-1
Berdasarkan
definisi tersebut, pH dan pOH untuk air pada 25°C dapat dihitung sebagai
berikut.
pH = –log [H+] = –log (1,0 × 10–7) = 7
pOH = –log [OH ] = –log (1,0 × 10–7) = 7
pH = –log [H+] = –log (1,0 × 10–7) = 7
pOH = –log [OH ] = –log (1,0 × 10–7) = 7
Prosedur yang sama juga diterapkan untuk
menghitung tetapan ionisasi air, yaitu pKw.
Kw = [H+] [OH– ] = 1,0 × 10–14
pKw = pH + pOH = 14
pH = 14 – pOH dan pOH = 14 – pH
Kw = [H+] [OH– ] = 1,0 × 10–14
pKw = pH + pOH = 14
pH = 14 – pOH dan pOH = 14 – pH
Hubungan α, Ka, dan Kb
Kekuatan asam ditentukan oleh kemampuan menghasilkan
ion H+. Semakin banyak ion H+ yang dihasilkan, semakin
kuat sifat asamnya. Begitu juga dengan kekuatan basa, sangat ditentukan oleh
kemampuan menghasilkan ion OH-. Semakin banyak ion OH-
yang dihasilkan, semakin kuat sifat basanya. Jumlah ion H+ atau ion
OH- yang dihasilkan ditentukan oleh nilai derajat ionisani (α), yang
dirumuskan sebagai berikut :
Makin besar Ka, maka makin kuat kuat asam
Makin besar Kb, maka makin kuat kuat
basa
|
- Asam kuat atau basa kuat adalah asam atau basa yang dalam air sebagian besar atau seluruh molekulnya terurai menjadi ion-ionnya.
- Asam lemah atau basa lemah adalah asam atau basa yang dalam air sebagian kecil molekulnya terurai menjadi ion-ionnya.
Menghitung pH Asam
Untuk menyatakan nilai pH suatu larutan
asam, maka yang paling awal harus ditentukan (dibedakan) antara asam kuat
dengan asam lemah.
pH Asam Kuat
Bagi asam-asam kuat ( α = 1), maka
menyatakan nilai pH larutannya dapat dihitung langsung dari konsentrasi asamnya
(dengan melihat valensinya).
Contoh:
Hitunglah pH dari 100 ml larutan 0.001 M
HCl !
HCl(aq) à H+(aq) + Cl-(aq)
[H+] = [HCl] = 0.001 = 10-3 M
pH = – log 10-3 = 3
[H+] = [HCl] = 0.001 = 10-3 M
pH = – log 10-3 = 3
Hitunglah pH dari 0,05 M H2SO4
!
H2SO4(aq) à 2 H+(aq) + SO42-(aq)
[H+] = 2[H2SO4] = 2 x
0.05 = 10-1 M
pH = – log 10-1 = 1
pH = – log 10-1 = 1
pH Asam Lemah
Bagi asam-asam lemah, memiliki harga
derajat ionisasinya (0 < α < 1) yang berarti senyawa ini terionisasi
tidak sempurna sehingga masih ada molekul yang tidak terionisasi.
Contoh:
Hitunglah pH dari 0,1 M CH3COOH, jika
diketahui Ka = 10-5
Menghitung pH Basa
pH Larutan
Basa Kuat
Untuk menentukan pH larutan basa kuat ( α = 1), maka
terlebih dahulu dihitung nilai pOH larutan dari konsentrasi basa.
Contoh:
a. Hitunglah pH dari 100 ml larutan KOH 0.1 M
a. Hitunglah pH dari 100 ml larutan KOH 0.1 M
KOH(aq) à K+ (aq) + OH–(aq)
[OH–] = 1 x [KOH] = 0.1 = 10 –1
pOH = – log [OH – ] = – log 10 –1
Jadi pH = 14 – pOH = 14 – 1 = 13
pOH = – log [OH – ] = – log 10 –1
Jadi pH = 14 – pOH = 14 – 1 = 13
b. Hitunglah pH dari 500 ml larutan Ca(OH)2 0.01 M
Ba(OH)2(aq) à Ba2+ (aq) + 2 OH– (aq)
[OH –] = 2 x [Ba(OH)2] = 2 x 0.01 = 2.10 –2 M
pOH = – log [OH–] = – log 2.10 –2
pOH = 2 – log 2
Jadi pH = 14 – pOH = 14 – (2 – log 2) = 12 + log 2
[OH –] = 2 x [Ba(OH)2] = 2 x 0.01 = 2.10 –2 M
pOH = – log [OH–] = – log 2.10 –2
pOH = 2 – log 2
Jadi pH = 14 – pOH = 14 – (2 – log 2) = 12 + log 2
pH Larutan
Basa Lemah
Bagi basa-basa lemah, memiliki harga derajat ionisasinya (0 < α < 1) yang berarti senyawa ini terionisasi tidak sempurna sehingga masih ada molekul yang tidak terionisasi.
Bagi basa-basa lemah, memiliki harga derajat ionisasinya (0 < α < 1) yang berarti senyawa ini terionisasi tidak sempurna sehingga masih ada molekul yang tidak terionisasi.
Hitunglah pH dari 100 ml 0.001 M larutan NH4OH, jika diketahui tetapan ionisasi basa, Kb = 10 –5
X-tra : Evaluasi Materi Asam Basa
1. Zat yang dalam
air dapat menghasilkan ion hidrogen positif disebut…
a. Basa b. garam c. asam d. Larutan
a. Basa b. garam c. asam d. Larutan
2. Zat yang dalam
air dapat menghasilkan ion hidroksida disebut…
a. Asam b. basa c. garam d. Larutan
a. Asam b. basa c. garam d. Larutan
3. Contoh asam yang dapat dijumpai sehari-hari, kecuali...
a. Sabun b. vitamin C c. cuka d. Aspirin
a. Sabun b. vitamin C c. cuka d. Aspirin
4. Berikut termasuk indikator
alami, yaitu…
a. Bunga sepatu, kunyit c. kulit manggis, lengkuas
b. Jahe lengkuas d. jahe, kubis, ungu
a. Bunga sepatu, kunyit c. kulit manggis, lengkuas
b. Jahe lengkuas d. jahe, kubis, ungu
5. Kertas lakmus merah jika
dimasukkan dalam suatu larutan sehingga menghasilkan warna merah, maka larutan
bersifat…
a. Basa b. garam c. netral d. asam
a. Basa b. garam c. netral d. asam
6. Sifat basa yaitu…
a. Sebagian bereaksi dengan logam menghasilkan H2
b. Memiliki rasa asam
c. Menghasilkan ion OH- dalam air
d. Menghasilkan ion H+ dalam air
7. Dari beberapa indikator
Indikator
|
Trayek
pH
|
Perubahan
warna
|
Metil
jingga
|
3,1
- 4,4
|
Merah-jingga
|
Metil
merah
|
4,2
- 6,2
|
Merah-kuning
|
Bromtimol
biru
|
6,0
- 7,6
|
Kuning-biru
|
Fenoptalein
|
8,3
- 9,6
|
Tak
berwarna-merah
|
Suatu sampel air sungai
diuji pH dengan ditetesi beberapa indikator :
- Dengan
metil jingga berwarna
jingga
- Dengan metil merah berwarna kuning
- Dengan bromtimol
biru berwarna
biru
- Dengan PP tak
berwarna
Maka pH sungai
diperkirakan sekitar…
a. 3,1
< pH < 7,6
c. 6,0 < pH <
8,3
b. 7,6 < pH < 8,3 d. 5,4 < pH < 6,0
8. Definisi asam menurut
Lewis adalah…
a. Donor
proton c. Spesi yang melepaskan ion
H+
e. Donor pasangan elektron
b. Akseptor
proton d. Akseptor pasangan electron
9. Yang termasuk asam
Lewis adalah…
a. CaO
b. MgO
10. Harga tetapan ionisasi
dari basah lemah LOH 0,1 M yang mengurai dalam air sebanyak 2% adalah
a. 6x10-5
b. 5x10-5
c.
d. 3x10-5
11. Diketahui reaksi :
HCOOH(aq) + HNO2(aq)
à
HCOOH2+(aq) + NO2-(aq)
Berikut yang merupakan
pasangan asam basa konjugasi adalah
a. HCOOH dan HNO3
b. HCOOH dan HCOOH2+
c. HCOOH dan NO2-
d. NO2-
dan HCOOH2+
e. HNO2 dan
HCOOH2+
12. Tabel harga Ka beberapa
asam adalah sebagai berikut :
No.
|
Asam
|
Ka
|
1.
|
HA
|
6,2
x 10-8
|
2.
|
HB
|
1,2
x 10-2
|
3.
|
HC
|
7,0
x 10-4
|
4.
|
HD
|
6,7
x 10-5
|
5.
|
HE
|
9,6
x 10-7
|
Diantara asam-asam
tersebut yag bersifat paling lemah adalah
a. HA
b. HB
c. HC
d. HD
13. Jika larutan P memiliki
pH = 5 dan larutan Q memiliki pH = 6, perbandingan konsentrasi ion hidrogen dalam larutan P dan dalam larutan Q...
a. 1 : 0,1
b. log 5 : log 6
c. 1 : 10
d. 5 : 6
14. Jika 1 mL larutan NaOH 1 M ditambahkan ke dalam 1 L air,
larutan ini akan memiliki pH sekitar...
a. 11
b. 9
c. 7
d. 5
15. Jika 90cm3 air ditambahkan ke dalam 10 cm3 larutan HCl 0,1 M, pH larutan berubah dari....
a. 11
b. 9
c. 7
d. 5
15. Jika 90cm3 air ditambahkan ke dalam 10 cm3 larutan HCl 0,1 M, pH larutan berubah dari....
a. 1 menjadi 2
b. 1 menjadi 3
c. 1 menjadi 5
d. 1 menjadi 4
Kunci Jawaban
1. C 2.
B 3. A 4. A 5. D
6. C 7.
B 8. D 9. C 10.
C
11. B 12.
A 13. D 14. A 15. A
Langganan:
Komentar (Atom)