Selamat Datang di website Belajar Asam Basa
Website ini berisi materi Asam Basa SMA kelas XI yang meliputi pengertian asam basa, teori asam basa, perhitungan pH, serta dilengkapi juga dengan evalusi untuk mengecek pemahaman siswa.
Pembuatan website dimaksudkan untuk memenuhi tugas akhir dari mata kuliah Pengembangan Media Pembelajaran.
Biodata Pembuat Website :
Nama : Rizky Dwi Fitriani
Kelas : Pendidikan Kimia B 2009
NIM : 093194212
Jurusan : Kimia - Universitas Negeri Surabaya
e-mail : rizkydwifitriani@ymail.com
Semoga website ini bermanfaat bagi siswa SMA untuk memperoleh literatur atau sumber materi asam basa. Selain itu pembuatan website ini juga diharapkan dapat memberikan solusi mengenai keterbatasan waktu tatap muka di sekolah antara guru dengan siswa. Dengan adanya website ini siswa tetap dapat memperoleh materi. Disisi lain website ini juga diharapkan dapat meingkatkan keterampilan psikomotor siswa dalam memanfaatkan teknologi informasi yang semakin berkembang ini.
Tentunya pembuatan website ini masih jauh dari kesempurnaan. Oleh karena itu masukan positif yang dapat meningkatkan kualitas website ini sangat diharapkan. Anda dapat mengirimkannya melalui e-mail yang tertera diatas.
Salam
Rizky Dwi Fitriani
Asam Basa
Blog ini berisi tentang materi-materi asam basa yang meliputi pengertian, teori, identifikasi, contoh dalam kehidupan sehari-hari, dan soal evaluasi.
Kategori
- * Home *
- * Kompetensi *
- Asam Basa Dalam Kehidupan Sehari-Hari
- Asam Basa Konjugasi
- Hubungan α - Ka - dan Kb
- Identifikasi Asam dan Basa
- Konsep pH
- Menghitung pH Asam
- Menghitung pH Basa
- Pengertian Asam dan Basa
- Teori Asam Basa Arhenius
- Teori Asam Basa Bronsted-Lowry
- Teori Asam Basa Lewis
- Tetapan Kesetimbangan Air (Kw)
- X-tra : Evaluasi
Rabu, 13 Juni 2012
Selasa, 12 Juni 2012
Kompetensi Pembelajaran
Standar
Kompetensi : Memahami sifat-sifat larutan asam-basa, metode
pengukuran, dan terapannya.
Kompetensi
Dasar :
Mendeskripsikan teori-teori asam basa dengan menentukan sifat larutan dan
menghitung pH larutan.
Indikator
Pembelajaran :
- Menjelaskan pengertian dan sifat-sifat dari larutan asam dan basa.
- Menjelaskan teori asam dan basa menurut Arrhenius.
- Menjelaskan teori asam dan basa menurut Bronsted dan Lowry.
- Menuliskan persamaan reaksi asam dan basa menurut Bronsted dan Lowry dan menunjukkan pasangan asam dan basa konjugasinya.
- Menjelaskan pengertian asam dan basa menurut Lewis.
- Mengidentifikasi sifat larutan asam dan basa dengan berbagai indikator.
- Menghitung dan menentukan tetapan kesetimbangan air (Kw)
- Menjelaskan pengertian kekuatan asam dan menyimpulkan hasil pengukuran pH dari beberapa larutan asam dan basa yang konsentrasinya sama.
- Menghubungkan kekuatan asam atau basa dengan derajat pengionan ( α ) dan tetapan asam (Ka) atau tetapan basa (Kb).
- Menghitung pH larutan asam atau basa yang diketahi konsentrasinya.
Pengertian Asam dan Basa
Asam didefinisikan sebagai senyawa yang menghasilkan ion hidrogen (H+) ketika
larut dalam pelarut (biasanya air).
Basa didefinisikan sebagai senyawa yang menghasilkan
ion hidroksida (OH-) ketika larut dalam pelarut air.
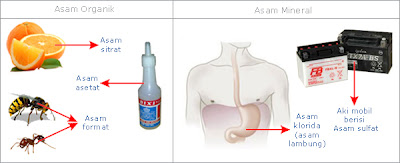
Asam Basa Dalam Kehidupan Sehari-Hari
Contoh-contoh Asam
Asam dapat dengan mudah
kita temui dalam kehidupan sehari-hari. Dalam makanan, minuman, buah-buahan,
air hujan bahkan di dalam tubuh kita. Berdasarkan asalnya, asam dikelompokkan
menjadi 2 kelompok, yaitu asam organik dan asam mineral.
Asam organik berasal
dari sumber alami (tumbuhan dan hewan), umumnya bersifat asam lemah. Contoh
asam organik adalah asam sitrat terdapat dalam buah jeruk, asam format terdapat
dalam gigitan/sengatan semut dan sengatan lebah dan asam asetat yang terdapat
dalam cuka makan. Asam mineral adalah senyawa asam seperti asam klorida (asam
lambung) terdapat dalam sistem pencernaan manusia dan hewan. Asam mineral
banyak juga dimanfaatkan oleh manusia untuk memenuhi kebutuhan sehari-hari dan
umumnya bersifat asam kuat. Contoh asam mineral adalah asam klorida yang
digunakan secara luas dalam industri, asam sulfat untuk aki mobil dan asam
fluorida yang biasanya digunakan pada pabrik kaca.
Berdasarkan kekuatannya
asam dibagi menjadi dua jenis, yaitu asam kuat dan asam lemah. Kekuatan suatu
asam dapat ditentukan dari kemampuannya melepaskan ion hidrogen yang bermuatan
positif (ion H+) ketika dilarutkan dalam air. Semakin banyak ion H+ yang
dilepaskan, semakin kuat sifat asamnya.
Berikut ini adalah tabel
beberapa contoh asam kuat dan asam lemah.
Contoh-contoh Basa
Sama halnya dengan zat
asam, zat basa juga dapat dengan mudah kita temui dalam kehidupan sehari-hari.
Sifat licin dan rasanya yang pahit merupakan cara mudah untuk mengenali zat
basa. Beberapa contoh zat basa yang sering digunakan adalah:
- Natrium hidroksida / soda api /
soda ash dan kalium hidroksida, sebagai bahan baku pembersih dalam rumah
tangga, misalnya sabun mandi, sabun cuci, detergen, pemutih dan pembersih
lantai
- Magnesium hidroksida dan
aluminium hidroksida, terkandung dalam obat nyeri lambung (antasid)
- Amoniak, untuk pelarut
desinfektan (pencegah terjadinya infeksi) dan bahan baku pupuk urea
Sama seperti asam, basa
juga dibedakan menjadi basa kuat dan basa lemah. Kekuatan suatu basa dapat
ditentukan dari kemampuannya melepaskan ion hidroksida yang bermuatan negatif
(ion OH-) ketika dilarutkan dalam air. Semakin banyak ion OH- yang
dilepaskan, semakin kuat sifat basanya. Semua rumus kimia basa umumnya
mengandung gugus OH-.
Jika diketahui rumus
kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama
logam dan diikuti kata hidroksida. Berikut ini tabel beberapa contoh basa kuat
dan basa lemah:
Teori Asam Basa Arhenius
Arhenius
mendefinisikan :
Jumlah
ion H+ yang dapat dihasilkan oleh 1 molekul asam
disebut valensi asam, sedangkan ion negatif yang terbentuk dari asam
setelah melepaskan ion H+ disebut ion sisa asam. Beberapa
contoh asam diberikan pada tabel :
Jumlah
ion OH- yang dapat dilepaskan oleh satu
molekul basa disebut valensi basa. Beberapa contoh basa diberikan pada tabel
:
Teori Asam Basa Bronsted-Lowry
Menurut Bronsted-Lowry :
Perhatikan reaksi
berikut :
Dari reaksi di atas terlihat bahwa CH3COOH memberi 1 proton (H +) kepada H2O, sehingga CH3COOH
bersifat sebagai asam dan H2O bersifat sebagai basa.
Asam Basa Konjugasi
Bronsted-Lowry
juga menyatakan bahwa jika suatu asam memberikan proton (H+), maka
sisa asam tersebut mempunyai kemampuan untuk bertindak sebagai basa. Sisa asam
tersebut dinyatakan sebagai basa konjugasi. Demikian pula untuk basa, jika
suatu basa dapat menerima proton (H+), maka zat yang terbentuk
mempunyai kemampuan sebagai asam disebut asam konjugasi.
Pada
reaksi tersebut terlihat bahwa H2O dapat bersifat sebagai asam dan
basa. Zat yang demikian disebut zat amfoter. Zat amfoter artinya zat yang
memiliki kemampuan untuk bertindak sebagai asam atau basa. Contoh lain yang
termasuk amfoter adalah HCO3–.
Contoh
basa konjugasi:
Asam →
Proton + Basa Konjugasi
HCl(aq)
⇄H+(aq)
+ Cl–(aq)
H2O(aq)
⇄H+(aq)
+ OH–(aq)
H2SO4(aq)
⇄H+(aq)
+ SO42–(aq)
NH4 +(aq) ⇄H+(aq) + NH
Contoh
asam konjugasi sebagai berikut.
Basa
+Proton → Asam Konjugasi
NH3(aq)
+ H+(aq) ⇄ NH4+(aq)
H2O(aq)
+ H+(aq) ⇄ H3O+(aq)
OH–(aq)
+ H+(aq)⇄ H2O(aq)
CO32–(aq)
+ H+(aq) HCO3–(aq)
Perhatikan
reaksi berikut:
HCl(aq)
+ H2O(l) ⇄ H3O+(aq)
+ Cl‑(aq)
Pasangan
asam-basa setelah terjadi serah terima proton dinamakan asam basa konjugasi.
a. HCl
dan Cl– merupakan
pasangan asam-basa konjugasi. HCl adalah asam konjugasi dari Cl–dan
Cl– adalah basa
konjugasi dari HCl.
b. H2O
dan H3O+ merupakan
pasangan asam-basa konjugasi. H2O adalah basa konjugasi dari H3O+ dan H3O+ adalah asam konjugasi dari H2O.
Berikut
ini contoh pasangan asam-basa konjugasi pada beberapa reaksi.
a. HNO3(aq)+
H2O(l) ⇄H3O+(aq)+
NO3–(aq)
b. H2O(l)
+ CN–(aq) ⇄
HCN(aq)+ OH–(aq)
c. H2SO4(aq)+
OH–(aq) ⇄ HSO4–(aq)
+ H2O(aq)
Langganan:
Postingan (Atom)